1 Sprech- und Darstellungsweisen auf dem Prüfstand
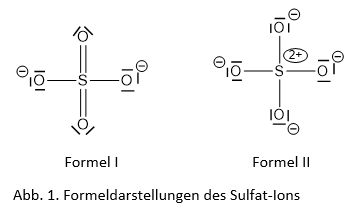
In Schulbüchern, teilweise aber auch in Hochschullehrbüchern, findet man verschiedene Formeldarstellungen für das Sulfat-Ion bzw. für die Schwefelsäure. Im klassischen Fall wird die Lewis-Formel mit zwei S=O-Doppelbindungen und mit zwei S-O-Einfachbindungen gezeichnet (Formel I). Demgegenüber finden sich in moderneren Hochschullehrbüchern vermehrt Formeln, bei denen das Sulfat-Ion mit vier S-O-Einfachbindungen und demnach vier einfach negativ geladenen Sauerstoff-Atomen und einem zweifach positiv geladenen Schwefel-Atom gezeichnet wird (Formel II) (Mortimer, Müller, Beck, 2015). In dieser Schreibweise gehorcht das Schwefel-Atom also der Oktettregel (Abb. 1).
Diese beiden Formeln haben einen historisch begründeten Ursprung. Es war kein geringerer als Gilbert Newton Lewis (1875-1946), der bei der Einführung seiner Elektronenpaarschreibweise feststellte, dass sich in den Molekülen und Ionen der Hauptgruppenelemente immer 8 Elektronen um ein Atom herum befinden (Jensen, 1984)
Die Lewisformel-Darstellung stößt aber scheinbar an ihre Grenzen, wenn in der Koordinationssphäre, insbesondere der schwereren Elemente der dritten und höheren Perioden, mehr als vier Atome oder vier Atome plus freie Elektronenpaare angeordnet sind. Um solche gewissermaßen „hypervalenten“ Fälle vernünftig erklären zu können, schlug Linus Pauling die sp3d-Hybridisierung für trigonal bipyramidale Moleküle, wie bei PF5 und die sp3d2-Hybridisierung für oktaedrische Molekül-Ionen wie bei PF6– vor. Pauling erschien die Ladungsanhäufung als ein ungünstigerer Zustand als die Erweiterung des Oktetts durch Einbeziehung von d-Orbitalen (Pauling, 1960).
Verwirrungspotenzial obiger Sprech- und Darstellungsweisen
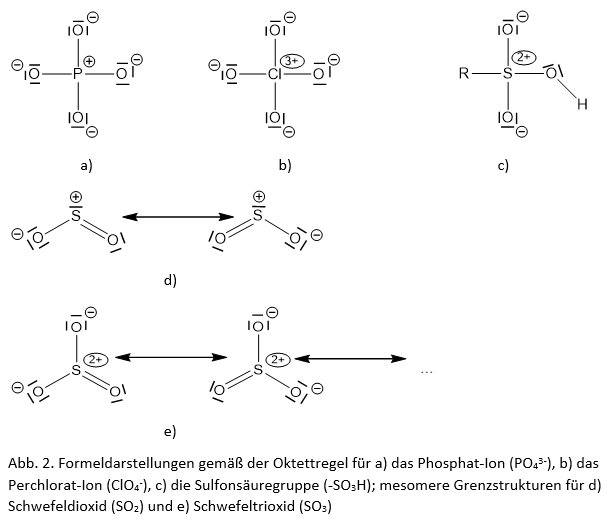
Betrachten wir die „traditionelle“ hypervalente Schreibweise (Formel I), so bereitet es Schüler/inne/n immer wieder Schwierigkeiten zu entscheiden, ob und wann denn nun eine Oktett-Erweiterung „erlaubt“ ist und wann nicht. Gerade bei den Stickstoff-Sauerstoff-Verbindungen ist es sehr verlockend, das Oktett unerlaubterweise zu überschreiten, etwa beim Nitrat-Ion zwei Doppelbindungen zu zeichnen.
Eine weitere Schwierigkeit bei dieser Darstellung taucht auf, wenn man sich die Struktur des Sulfat-Ions näher anschaut oder das Elektronenpaar-Abstoßungsmodell bemüht, um den räumlichen Aufbau vorherzusagen. Tatsächlich ist das Sulfat-Molekül nämlich symmetrisch tetraedrisch aufgebaut, mit gleich langen S-O-Abständen und regelmäßigen Winkeln (Mortimer, Müller & Beck, 2015). Hier muss dann das Mesomerie-Konzept ergänzend hinzugezogen werden, wonach die Formel nur eine von sechs Grenzstrukturen darstellt, der tatsächliche Zustand aber dazwischen liegt. Dies ist besonders problematisch, da im Chemieunterricht die Einführung der Lewis-Schreibweise und des Elektronenpaar-Abstoßungsmodells in der Regel in der Sek I erfolgt, zumeist in Klasse 9/10, die Delokalisation und die mesomeren Grenzstrukturen aber erst in der Sek II thematisiert werden. Man muss als Lehrender also entweder um solche Beispiele „herumgreifen“ oder „falsche“ Darstellungen bzw. Unstimmigkeiten in Kauf nehmen.
Andererseits lässt sich dieses Problem ohnehin nicht ganz umgehen, da etwa in den Formeln des SO2- oder des SO3-Moleküls bei strenger Gültigkeit der Oktettregel ebenfalls Resonanzstrukturen vorkommen.
Die Gültigkeit der Oktettregel bringt in der Regel mehr Formalladungen in die Formeldarstellung. Dies sorgt bei vielen Schüler/inne/n für Schwierigkeiten. Diese sind allerdings nicht vermeidbar, denn bei der Lewis-Schreibweise die Formalladungen zu bestimmen, durch Abzählen der Elektronen um ein Atom herum und Differenzbildung zur Zahl der Valenzelektronen laut Stellung im Periodensystem, gehört zum Grundhandwerkszeug bei der Formelschreibweise. Da bei strenger Gültigkeit der Oktettregel meist mehr Formalladungen in die Formeldarstellungen kommen, ergeben sich zusätzliche Möglichkeiten der Übung, die den Lernenden helfen können, mit diesem Sachverhalt kompetent umzugehen.
2 Vorschläge zur Minimierung von Verwirrung und Verständnisschwierigkeiten
Bereits seit den 1980er Jahren zeigten quantenmechanische Berechnungen, dass sich die Bindungsverhältnisse in „hypervalenten“ Molekülen oder Ionen wie auch ohne die Beteiligung von d-Orbitalen beschreiben ließen (Kutzelnigg, 1984). Zu Beginn dieses Jahrhunderts konnten Elektronendichtebestimmungen durch Röntgenstrukturanalysen an vielen Beispielen die Gültigkeit der Oktettregel belegen. Vielleicht am deutlichsten wurde dies am Beispiel der hochaufgelösten Elektronendichtebestimmung des Kaliumsulfats K2SO4 (Schmøkel et al., 2012) zusammengefasst in (Irmer, Stalke, 2017). Diese Untersuchungen zeigen für das Sulfat-Ion sehr überzeugend, dass alle S-O-Bindungen als reine σ-Bindungen mit polaren Anteilen (dies verursacht auch die Verkürzung gegenüber einer reinen Einfachbindung) beschrieben werden können. An den (formal einfach negativ geladenen) Sauerstoff-Atomen sind jeweils drei Elektronendichtemaxima zu beobachten, die als freie Elektronenpaare gedeutet werden können. Das Schwefelatom weist eine Elektronendichte auf, die mit einer zweifach positiven Ladung gut in Übereinstimmung steht.
Damit gibt die Formeldarstellung (II) in Abb. 1 unter Beachtung der Oktettregel die Bindungsverhältnisse im Sulfat-Ion sehr viel besser wieder als die Formeldarstellung (I). Gleiches gilt für hypervalenten Moleküle wie Schwefeldioxid, Schwefelsäure und Phosphorsäure oder weitere Ionen wie das Phosphat.
An dieser Stelle stellt sich weniger die Frage, wie man es Schüler/inne/n „leichter“ machen kann, sondern eher die Frage, inwieweit man mit seiner Schreibweise dem „tatsächlichen“ Zustand des Moleküls oder Ions nahekommt, also geht es primär um die fachliche Korrektheit. Wenn dabei eine für die Schüler/innen einfachere Vorgehensweise herauskommt, umso besser.
3 Abwägung
Die Formeldarstellung unter Berücksichtigung der Oktettregel gibt die Bindungsverhältnisse in „hypervalenten“ Molekülen oder Ionen der Hauptgruppenelemente wie Schwefelsäure, Sulfat, Phosphorsäure oder Phosphat besser wieder als eine Schreibweise mit Erweiterung des Oktetts. Für Schüler/innen bietet diese fachlich korrektere Darstellung auch noch eine Erleichterung bei der Formelschreibweise. So entfällt die Unterscheidung zwischen der Einhaltung der Oktettregel in der zweiten Periode und der Erweiterung in der 3. und höheren Periode.
4 Impulse zum Weiterdenken
Auf ein paar Fallstricke sei noch hingewiesen.
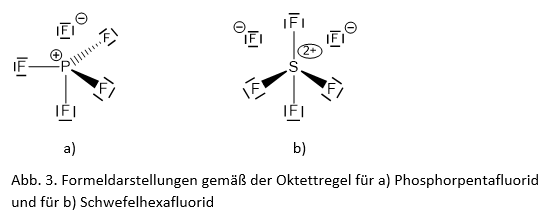
Moleküle wie PF5 oder SF6 müssen dann konsequenterweise in Ionen aufgeteilt geschrieben werden (Abb. 3). Andererseits spielen diese Verbindungen im schulischen Chemieunterricht jedoch kaum eine Rolle.
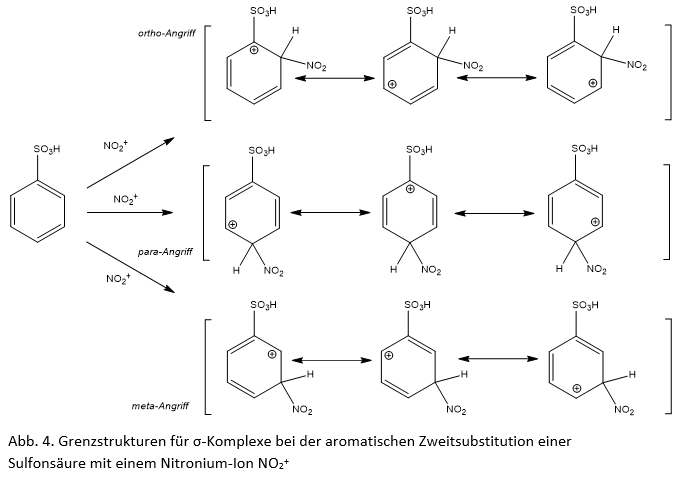
Eine Tücke lauert an einer ganz anderen Stelle. Zeichnet man auch die Sulfonsäuregruppen
(-SO3H) an aromatischen Systemen konsequenterweise gemäß der Oktettregel mit vier Einfachbindungen, so lässt sich kein –M-Effekt mehr formulieren, der z.B. die meta-dirigierende Wirkung der Sulfonsäuregruppe bei der elektrophilen Zweitsubstitution (z.B. Nitrierung von Sulfonsäuren) erklären kann. Allerdings braucht man nicht unbedingt einen M-Effekt, um die dirigierende Wirkung zu beschreiben. Formuliert man die σ-Komplexe z.B. für die Nitrierung der Sulfonsäure an den verschiedenen Ringpositionen, so erkennt man, dass beim Angriff des Nitrosyl-Kations in ortho- oder para-Stellung am Ring-C-Atom, das die Sulfonylgruppe trägt, sich eine Grenzstruktur mit einer positiven Ladung ergibt (Abb. 4). Dies ist energetisch ungünstig, da das Schwefel-Atom ja ebenfalls eine positive Ladung trägt. Nur bei Substitution in meta-Position existiert keine Grenzstruktur mit einer solchen positiven Ladung am der Sulfogruppe unmittelbar benachbarten C-Atom. Einige Organik-Lehrbücher arbeiten deshalb schon gar nicht mehr mit M-Effekten (SYKES, 1996).
Literatur
Irmer, E.; Stalke, D. (2017). Chemische Bindung unterrichten - ein Plädoyer für die Oktettregel. MNU-Journal 70(4), 227–234.
Jensen, W. B. (1984). Abegg, Lewis, Langmuir and the Octet Rule. Journal of Chemical Education 61(3), 191–200.
Kutzelnigg, W. (1984). Die chemische Bindung bei den höheren Hauptgruppenelementen. Angewandte Chemie 96(4), 262–286.
Mortimer, C. E., Müller, U., Beck, J. (2015). Chemie. Das Basiswissen der Chemie, 12. Aufl. Thieme, Stuttgart.
Pauling, L. (1960). The nature of the chemical bond and the structure of molecules and crystals. An introduction to modern structural chemistry, 3. Aufl. Cornell Univ. Press, Ithaca, New York.
Schmøkel, M. S., Cenedese, S., Overgaard, J., Jørgensen, M. R. V., Chen, Y.-S., Gatti, C., Stalke, D., Iversen, B. B. (2012). Testing the concept of hypervalency: charge density analysis of K2SO4. Inorganic chemistry 51(15), 8607–8616.
Sykes, P., Hopf, H. (Hrsg.) (1996). Wie funktionieren organische Reaktionen? Reaktionsmechanismen für Einsteiger. VCH, Weinheim.
Erhard Irmer ist Lehrer am Otto-Hahn-Gymnasium in Göttingen und derzeit im Schülerlabor XLAB der Universität Göttingen unter anderem für die Einbindung von Lehramtsstudierenden zuständig. Neben der Durchführung von Lehrerfortbildungen war er Mitherausgeber der Zeitschrift „Praxis der Naturwissenschaften - Chemie in der Schule“ und ist als Schulbuchautor und Redakteur bei der Zeitschrift „CHEMKON“ tätig.
Georg-August-Universität Göttingen, XLAB – Göttinger Experimentallabor für junge Leute, Justus-von-Liebig-Weg 8, D-37077 Göttingen, Tel. 0551 39 25270
