1 Einleitung
Ziel aller chemiedidaktischen Diskussionen ist es, die Voraussetzungen zu verbessern, dass die Lernenden mit Freude und stetig wachsendem Interesse die Chemie kennen- und verstehen lernen. Dazu bedarf es neuer Erfolgserlebnisse, die im Gehirn der Lernenden für dieses große Vorhaben quasi mehr Bereiche freischalten. Förderlich ist dafür, wenn gesammelte Erfahrungen möglichst problemlos zu immer größerem Verständnis führen, wenn die Lernenden merken, dass eigene Überlegungen sich als richtig erweisen. Hinderlich ist es, wenn als sicher abgespeicherte Erkenntnisse plötzlich durch Brüche in benutzten Theorien und Modellvorstellungen wieder unsicher werden.
Wenn z.B. anhand einer Reaktion von Magnesium mit Sauerstoff gelehrt wird, dass das eine Oxidation oder auch eine Oxidationsreaktion ist, weil Sauerstoff aufgenommen wird, so schafft das bereits für die Verbrennung von Magnesium mit Schwefel ein unlösbares Problem. Diesbezügliche Probleme werden nicht dadurch gelöst, dass man das Modell „erweitert“, indem man sagt, dass fortan eine Oxidation eine Elektronenabgabe ist. Das ist eben keine Erweiterung, sondern ein Bruch in der Kette der eigentlich der Erklärung dienenden Modelle.
Wenn ich Fachkollegen auf solche Probleme angesprochen habe, habe ich sehr oft Antworten bekommen, wie „Das kann man doch sagen, dass das so genau nicht gemeint war. Schließlich kann man darauf doch aufbauen.“ oder: „In der Oberstufe werden die, wie wir ja auch, damit zurechtkommen“.
Die Lernenden erwarten, dass die Lehrenden versuchen, ihnen die Welt der Chemie nach dem heutigen Stand der Wissenschaft zu erklären, dass sich die Lehrenden für einen optimalen Unterricht einsetzen und dafür auch traditionelle, eingefahrene und daher vielleicht bequeme Wege verlassen. Es wird von den Lehrenden so viel Empathie erwartet, dass sie von sich aus aktiv erspüren, wenn Konzepte und Begrifflichkeiten den Lernprozess unnötig erschweren.
Was die Lernenden nicht erleben wollen: Dass ihr Vorwissen nicht registriert und gewürdigt wird oder als für den geplanten Unterricht als eher hinderlich erachtet wird. Und dass man ihren Drang nach Erkenntnis und Verständnis dadurch ausbremst, dass man sie die Irrungen und Wirrungen unserer Vorfahren gnadenlos nacherleben lässt.
Warum veranlasst man die Kinder, sich Stoffe (zunächst) als ein Kontinuum vorzustellen, wo ihnen spätestens seit der Vorschule geläufig ist, dass alles aus Teilchen besteht? Alte Anekdoten und Versuche, die eine Teilchenvorstellung plausibel machen, kann man natürlich trotzdem bringen.
Ein weiteres Beispiel: Wenn man den Teilchenbegriff „eingeführt“ hat, sollte man aufpassen: leichtfertig eingeführte „Kochsalzteilchen“ z.B. können für das Verständnis eines Ionengitters durchaus hinderlich sein. Man sollte eben keine falschen Fährten legen. Das gilt auch für den Elementbegriff, wie im Folgenden gezeigt wird.
2 Die in der Schule übliche Verwendung des Elementbegriffs auf dem Prüfstand
Im 18. Jh. machte der Chemiker Lavoisier mit Hilfe eines riesigen Brennglases Themolyse-versuche.
Er zersetzte damit z. B. Diamant und Grafit, wobei in seiner Versuchsanordnung durch Zutritt von Sauerstoff in beiden Fällen umgehend Kohlenstoffdioxid entstand. Diese beiden so sehr verschiedenen Stoffe offenbaren in diesem Versuch, dass sie ein gemeinsames „Wesen“ haben. Heute würde man sagen, die Versuche zeigen, dass die beiden so verschiedenen Stoffe offenbar aus den gleichen Atomen bestehen. Da man im 18. Jh. von Atomen als „Grundbausteinen“ der Materie nichts wusste, musste sich Lavoisier entsprechend allgemein ausdrücken. Er sprach von einem diesen „substances simples“ innewohnenden elementaren, grundlegenden „principe“. In diesem Fall von dem „Prinzip“ bzw. dem „Element“ Kohlenstoff.
Dieser Elementbegriff wurde bald, vielleicht um ihn „greifbarer“ zu machen, abgewandelt: Aus dem elementaren Prinzip in einem solchen Stoff mit „elementarem“ Charakter wurde ein elementarer Stoff, ein (stoffliches) „Element“.
Dumm gelaufen! Vor allem dumm, weil man heute, über 100 Jahre nach der Erkenntnis, dass Elemente Atomsorten mit spezifischer Protonenzahl sind, in den Schulbüchern der SI noch immer dieser eher volkstümlich-anschaulichen Vorstellung treu bleibt und, wider besseres Wissen, die Elemente als Stoffe bezeichnet. „Fake News“!
3 Verwirrungspotenzial zweier sich widersprechender Elementdefinitionen
Wenn in der Tageszeitung steht, dass Forscher in Darmstadt ein neues Element entdeckt haben, glaubt selbst ein wenig begabtes Kind nicht, dass die Forschenden aus einem Bergwerk in Darmstadt einen neuartigen Metallklumpen zu Tage gefördert haben. Jeder Lernende, der eine solche Meldung liest, sofern er durch den Chemieunterricht noch nicht völlig verdorben ist, wird sie so verstehen, wie es dort auch steht, dass nämlich die Forschenden ein neues Element, d. h. ein bislang unbekanntes Atom erzeugt und nachgewiesenen haben. Genau gesagt haben sie sogar nur anhand seiner Zerfallsprodukte nachgewiesen, dass es kurzfristig einen entsprechenden Atomkern gegeben hat.
Sollen wir, nur weil es die Schulbücher der Sekundarstufe I so darstellen, den Lernenden nach wie vor erzählen, dass Elemente Stoffe sind, die man an ihren Eigenschaften erkennt? Könnte man da nicht einfacher die Bücher der SI an die der SII anpassen? Sollen wir, wenn ein Lernender sein z. B. aus einer Apothekerzeitung entnommenes Wissen kundtut, indem er sagt, dass Milch viel Calcium enthält, entsetzt aufheulen und sagen, dass das falsch ist, weil dieser Stoff gar nicht in der Milch sein kann, da er sofort mit Wasser reagieren würde? Natürlich hat der Lernende Recht, dass das Element Calcium (d.h. die Atomsorte) stark in der Milch vertreten ist!
Die Elemente waren in der Vergangenheit die kleine Gruppe der „Grundstoffe“, also Stoffe, aus denen alle anderen Stoffe aufgebaut sein sollten. Wenn aber Elemente nur durch die Zahl der Protonen im Atomkern definiert sind, kann es keine Stoffgruppe der Elemente geben. Da hilft es auch nichts, die alte Stoffgruppe der „Elemente“ jetzt, wie es zunehmend gemacht wird, „elementare Stoffe“ zu nennen, da Stoffe ja tatsächlich nicht elementar sind. Ozon oder Wasser enthalten keinen Sauerstoff (O2), sondern Sauerstoffatome.
Als mit der Entdeckung der Protonen das hinter der ursprünglich stoffbezogenen Ordnung des Periodensystems stehende Prinzip deutlich wurde, hätte man eine scharfe Trennung zwischen der submikroskopischen und der makroskopischen Ebene vollziehen müssen, anstatt sich an die alte Tradition zu klammern.
Wie konnte es überhaupt passieren, dass heute, über hundert Jahre nach der unbestritten korrekten Erkenntnis, dass Elemente Atome mit spezifischer Protonenzahl sind, in den Schulbüchern noch immer an einer stoffbezogenen Definition der Elemente festgehalten wird? Erklären lässt es sich vielleicht durch unsere Denkmuster: Nichts ist so fest verankert in unserem Gehirn wie Paare von Begriffen: hell und dunkel, Krieg und Frieden, Ying und Yang, … und so auch Elemente und Verbindungen.
4 Vorschläge zur Minimierung von Verwirrung und Verständnisschwierigkeiten
4.1 Zum Elementbegriff
Was machen wir mit den alten, stofflichen „Elementen“, die jetzt keine Elemente mehr sind? Nun, da diese Stoffe keine elementare Funktion mehr haben, ist ihr einziges Alleinstellungsmerkmal, dass sie aus nur einer Atomsorte bestehen. Die Art der chemischen Bindungen zwischen ihren Atomen ist im Prinzip genauso, wie bei anderen Stoffen auch: Alle chemischen Bindungen beruhen auf der Anziehung von positiv geladenen Atomkernen und negativ geladenen Elektronen von Nachbaratomen.
Zwei Beispiele zu chemischen Bindungen:
Bei der „Ionenbindung“ unterstellt man die weitgehende Anziehung von Elektronen eines Atoms in den Anziehungsbereich eines anderen Atomkerns, wodurch mehr oder minder stark ausgeprägte Ionen entstehen. Bei der „metallischen Bindung“ ziehen Atomrümpfe, quasi als Kationen, sogenanntes „ Elektronengas“ (quasi delokalisierte Elektronen als gewisse Entsprechung zu Anionen) an. Bei beiden Bindungstypen bilden sich Gitter.
Entsprechende Verhältnisse finden sich bei allen Bindungstypen. In dieser Hinsicht nehmen allein die Edelgase eine Sonderstellung ein. Ihre Atome gehen keine (besser gesagt so gut wie nie) Bindungen ein, da ihre Außenelektronen im Normalfall nicht in den hinreichend starken Anziehungsbereich der Nachbaratome gelangen. Soll man also für die Stoffgruppe der ehemaligen „Elemente“ überhaupt eine neue Sammelbezeichnung einführen? Wenn man die formale Besonderheit solcher Stoffe, dass sie Verbindungen aus nur einer Atomsorte sind, hervorheben möchte, bietet sich die Bezeichnung „Einelementverbindung“ an. Das wäre dann ein Pendant zu „Mehrelementverbindungen“ (SCHMIDT 1989, WENZL 2009).
Da aber „Einelementverbindungen“ oder „elementare Verbindungen“ keine prinzipiellen Unterschiede zu „Mehrelementverbindungen“ aufweisen, sind diese Bezeichnungen eigentlich überflüssig und sollten der Übersicht halber vielleicht besser weggelassen werden. Schließlich werden auch Zweielementverbindungen nicht hervorgehoben.
4.2 Zum Verbindungsbegriff
Was machen wir jetzt mit dem Pendant zu den alten, stofflich definierten Elementen, den sogenannten „Verbindungen“? Das Sortieren der Stoffe in die zwei uns (Alten) so geläufigen Schubladen „Element und Verbindung“ geht nun nicht mehr. Als Verbindungen wurden (und werden in Schulbüchern noch immer) Stoffe bezeichnet, die durch Verbindung von mindesten zwei (stofflich definierten) „Elementen“ entstanden sind.
Nun können sich nach wie vor zwei oder mehr verschiedenartige Atome miteinander verbinden, genauso, wie sich auch zwei oder mehr gleichartige Atome miteinander verbinden können. Was spricht dagegen, in beiden Fällen die daraus resultierenden Stoffe „Verbindungen“ zu nennen? Sowohl in H2 und O2 als auch in H2O als Beispiele sind jeweils Atome miteinander verbunden.
4.3 Übersicht zur Neuordnung der Begriffe
Man wird den scheinbar unauslöschlichen stoffbezogenen Elementbegriff nur in die Geschichtsbücher verbannen können, wenn man sich von dem angestammten Begriffspaar „Element und Verbindung“ verabschiedet und es durch ein passenderes Paar ersetzt.
Hier ergibt sich quasi zwangsläufig das Paar „Elemente und Stoffe“, da die nun nicht mehr stofflichen Elemente als Atomsorten ganz grundsätzlich den Stoffen gegenüberstehen. Als Untergliederung der Stoffe könnte man „atomare Stoffe“ und „Verbindungen“ unterscheiden, die ihrerseits weiter zu differenzieren sind (siehe unten).
Elemente und Stoffe: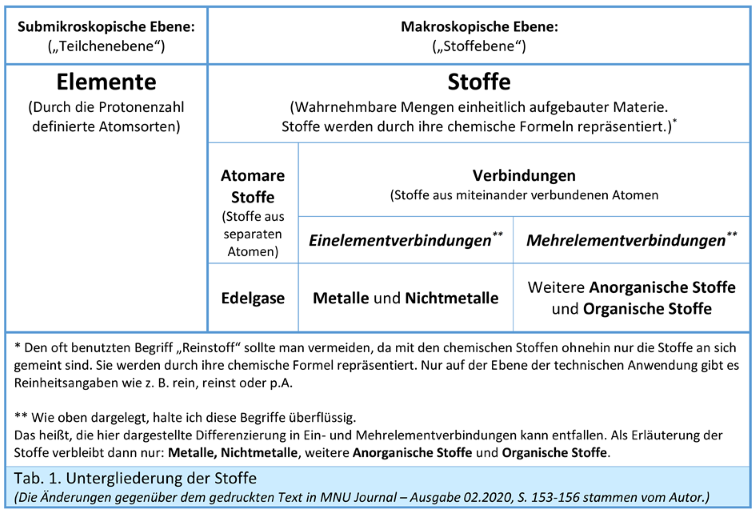
5 Abwägung
Die vorgeschlagenen Neudefinitionen besagter Begriffe bedürfen zwar einer Umgewöhnung, haben aber einen entscheidenden Vorteil:
Sie stehen im Unterschied zur bisherigen Praxis im Einklang mit der didaktisch gebotenen sauberen Trennung von Stoff - und Teilchenebene.
Das überkommene, rein stofflich definierte Begriffspaar „Elemente und Verbindungen“ wird ersetzt durch das Begriffspaar „Elemente und Stoffe“.
Die Frage „Ist das ein Element oder eine Verbindung?“ wird es dann nicht mehr geben.
6 Impulse zum Weiterdenken
Stoffe wie z. B. Sauerstoff, Ozon, Grafit oder das Buckminsterfulleren C60 sind Verbindungen wie alle anderen auch. Damit können wir einen überflüssigen und irreführenden bzw. aus heutiger Sicht unpassenden Begriff entsorgen: die „Modifikationen eines Elements“. Ein Element, das allein durch die Zahl seiner Protonen definiert ist, wobei das Atom ja auch ohne Elektronenhülle als entsprechend geladenes Atom noch immer dasselbe Element repräsentiert, kann man kaum modifizieren. Wenn man die Zahl der Protonen ändert, erhält man ein anderes Element.
Modifikationen von Elementen kann man nur erhalten, indem man die Zahl der Neutronen ändert. Diese Modifikationen haben aber schon einen Namen. Man nennt sie Isotope. Und dabei soll es natürlich bleiben. Sollte man für Stoffe wie Ozon und Sauerstoff, die aus lediglich ein und dem selben Element aufgebaut sind, einen gemeinsamen Namen finden? Ist ein eigener Ausdruck dafür überhaupt notwendig?
Literatur:
SCHMIDT, W. (1989). In: L.KOLDITZ (Hg): Anorganikum. Berlin: VEB Deutscher Verlag der Wissenschaften, 356.
WENZL, E. (2009). Chemische Elemente – Stoffe oder Teilchenarten? In: MNU 62(07), 434-437. Siehe dazu auch die Diskussionsbeiträge von H.-J. SCHMIDT, J. HÄHNDEL und E. WENZL in MNU 63(02), 111-112.
Der vorliegende Beitrag bezieht sich auf meine Vorträge auf den MNU-Tagungen in Bremerhaven vom 16.11.2009: „Elemente sind Verbindungen!? Neue Begriffsdefinitionen“ und vom 15.11.2010: „Was sollen Schüler unter Elementen verstehen? Diskussion des Elementbegriffs“.
JOACHIM HÄHNDEL, Oldenburg, , war Lehrer für Chemie und Biologie am Gymnasium Brake.
