Was hält Teilchen zusammen: Bindungen, Kräfte oder Wechselwirkungen? Wie differenziert sollen wir diese Phänomene im Unterricht betrachten und wie können wir dabei die Zahl der zu lernenden Begriffe möglichst gering halten, dabei aber fachlich korrekt arbeiten? Ist zu unterscheiden zwischen Phänomenen innerhalb von Teilchen und solchen zwischen verschiedenen Teilchen? Weil Lernende bei diesem Thema immer wieder stutzig werden, gehört es auf den Prüfstand. Diskutieren Sie mit über die vorgelegten Vorschläge zum Sprachgebrauch!
1 Sprech- und Darstellungsweisen auf dem Prüfstand
Sowohl in der (Schulbuch)-Literatur als auch im alltäglichen Sprachgebrauch unter Chemikern findet man für dasselbe Phänomen die Bezeichnungen »Zwischenmolekulare Kräfte«,»Zwischenmolekulare Wechselwirkungen« oder »Zwischenmolekulare Bindungen«, teilweise sogar innerhalb eines Werkes relativ undifferenziert nebeneinander. Es scheint also keine Unterschiede zwischen Kraft, Wechselwirkung und Bindung zu geben.
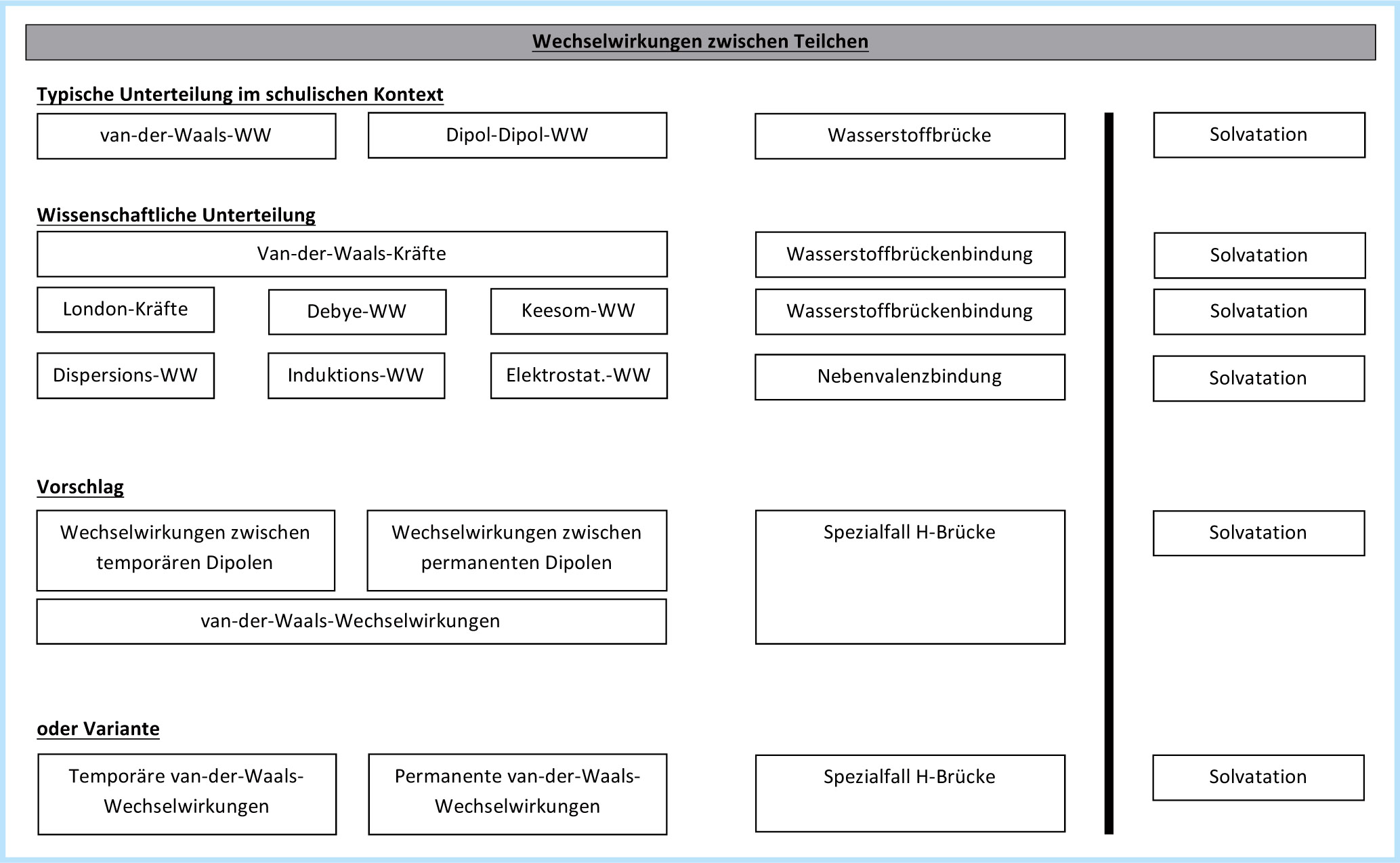
In den meisten Fällen werden diese zwischenmolekularen »Phänomene« dann unterteilt in van-der-Waals-..., Dipol- bzw. Dipol-Dipol-... und Wasserstoffbrücken(bindungen). Andere Lehrbücher verwenden die Bezeichnung van-der-Waals-Kräfte als überbegriff und differenzieren diese in Dispersions- und Di- pol-Dipol-Kräfte.
2 Verwirrungspotenzial obiger Sprech- und Darstellungsweisen
A) Es wird kaum unterschieden zwischen den (unterschiedlich starken) elektrostatischen Anziehungskräften als Ursache und den sich daraus ergebenden Wechselwirkungen als Folge. Auch eine Abgrenzung zur »echten« chemischen Bindung findet häufig nicht statt.
B) Der Begriff »zwischenmolekular« ist gleich in mehrfacher Weise irreführend. Insbesondere bei Makromolekülen treten gleichartige Wechselwirkungen (zur Vereinfachung verwenden wir ab hier nur noch die Bezeichnung »Wechselwirkung«, wenn keine Differenzierung notwendig ist) innerhalb eines einzigen Moleküls zwischen unterschiedlichen Molekülteilen auf und eben nicht nur zwischen benachbarten Molekülen. Auch benachbarte Atome untereinander (wie z. B. Edelgasatome) einerseits und Atome mit Molekülen andererseits, können in vergleichbarer Weise wechselwirken. Nicht zuletzt handelt es sich bei der Solvatation von Ionen durch Moleküle ebenfalls um eine verwandte Form der Wechselwirkung.
C) Die Bezeichnung »Dipol-Dipol-Wechselwirkung« für lediglich eine spezielle Untergruppe führt bei Lernenden häufig zu Unverständnis. Es erscheint ihnen nicht logisch, genau diese spezielle Form als Dipol-Dipol-Wechselwirkung zu bezeichnen, wo doch die beiden anderen Untergruppen bei genauer Betrachtung ebenso Dipol-Dipol-Wechselwirkungen sind. Dass der tatsächlich einzige Unterschied − nämlich ob die Dipole nun temporär, permanent oder aber mit besonders starker Ausprägung ausgebildet sind − in der Bezeichnung nicht nur nicht klar wird, sondern die Benennung gar Fehlvorstellungen unterstützend wirkt, bemängeln diese Lerner zurecht. Zudem ist die Unterscheidung in van-der-Waals-WW und Dipol- Dipol-WW fachlich nicht korrekt. Bereits vor über 20 Jahren legte die IUPAC den Begriff van-der-Waals-forces als überbegriff fest. Die Bezeichnung »van-der-Waals-Kräfte im engeren Sinn« als synonym für London-Kräfte sollte daher aus unserer Sicht wegen naheliegender Verwechslungsmöglichkeiten mit dem überbegriff vermieden werden. Sicher stellt dies für Lernende in der Schule zunächst kein Problem dar. Aber spätestens beim Wechsel an eine korrekt benennende Hochschule muss derselbe Begriff mit neuem Inhalt im selben Kontext verknüpft werden und Lehramtsstudierende müssen mit Beginn des Vorbereitungsdienstes erneut umlernen. Dass dies zu Unklarheiten führen kann, liegt auf der Hand.
D) Die sehr bildhafte Bezeichnung Wasserstoffbrückenbindung generiert bei Lernenden teilweise die fehlerhafte Vorstellung, elementarer Wasserstoff könnte hier eine Brückenfunktion einnehmen. Außerdem wird durch die sprachlich nicht saubere Trennung zwischen einem Phänomen innerhalb eines Moleküls und einem Phänomen zwischen Molekülen die Vorstellung vom Sieden molekularer Substanzen erschwert. Die nicht tragfähige Schülervorstellung, dass hierbei Bindungen gespalten würden, stabilisiert sich noch durch diese Bezeichnung, da dann beim Sieden von z. B. Wasser ja tatsächlich Wasserstoffbrückenbindungen gespalten würden, also eben doch »Bindungen«.
3 Vorschläge zur Minimierung von Verwirrung und Verständnisschwierigkeiten
Eine vergleichende übersicht zu den folgenden Ausführungen bildet die beigefügte Abbildung.
Zu A) Die konsequente Verwendung des Begriffs »Wechselwirkung« für die zu betrachtenden Phänomene könnte hier hilfreich sein. Dadurch wird es in diesem Zusammenhang nicht nötig, sich tiefergehend mit dem physikalischen Kraft-Begriff und den damit verbundenen Schwierigkeiten auseinander zu setzen. Die Möglichkeit, elektrostatische Anziehungskräfte ganz allgemein als Ursache der Wechselwirkungen anzusprechen, bleibt davon unberührt. Auch kann von elektrostatischen Anziehungskräften als Ursache der echten chemischen Bindung gesprochen werden, ohne in der Stärke differenzieren zu müssen. Es muss nur auf andere Weise, didaktisch reduziert, sauber zwischen Wechselwirkung und chemischer Bindung unterschieden werden. Als Unterscheidungsmerkmal schlagen wir vor, den Einfluss auf die stofflichen Eigenschaften zur Hilfe zu nehmen. Wechselwirkungen verursachen auf Teilchenebene in erster Linie die physikalischen Eigenschaften der betrachteten Stoffe, wohingegen (echte chemische) Bindungen in erster Linie für die chemischen Eigenschaften der Stoffe verantwortlich sind. Hier könnte eventuell eingewendet werden, Ursache für die Zersetzung von Makromolekülen beim Erwärmen und damit für chemische Reaktionen seien ihre starken Wechselwirkungen und nicht ihre chemischen Bindungen. Dies ist allerdings nur bei oberflächlicher Betrachtung stimmig: Wechselwirkungen und Bindungen stehen hier in Konkurrenz. Ursache für die chemische Reaktion der Zersetzung ist die im Vergleich zur Wechselwirkung schwache Bindung, die damit wiederum für die chemischen Eigenschaften hauptverantwortlich ist. Die vorgeschlagene Begrifflichkeit ist also auch hier in sich stimmig.
Somit wird eine für die Lernenden nachvollziehbare, einfache Begriffsabgrenzung erreicht, die die verbreiteten, einerseits synonymen, andererseits aber auch homonymen Verwendungen der Begriffe Kraft, Wechselwirkung und Bindung vermeidet: »Kräfte« sind jeweils die Ursache der Phänomene »Wechselwirkung« und »Bindung« auf Teilchenebene, die für jeweils unterschiedliche Eigenschaften auf stofflicher Ebene verantwortlich sind.
Zu B) Durch die unter A) ausgeführte klare Unterscheidung von Kraft, chemischer Bindung und Wechselwirkung wird die vorangestellte problematische Bezeichnung »zwischenmolekular« obsolet. Sie war bisher nötig, um von den innermolekularen Bindungen oder Kräften abzugrenzen. Die Unterscheidung in »Wechselwirkungen zwischen Teilchen« für die in C aufgeführten Phänomene einerseits, und »Bindungen zwischen Teilchen« für Ionen-, Elektronenpaar-, Metall- oder koordinative Bindungen andererseits, ist ausreichend und sogar eindeutiger.
Zu C) Laut IUPAC werden die van-der-Waals-Wechselwirkungen wissenschaftlich korrekt unterteilt in London-Kräfte, Keesom- Wechselwirkungen und Debey-Wechselwirkungen. Daneben stehen als Spezialfall die Wasserstoffbrückenbindungen. Basis für diese Unterscheidung bilden in erster Linie die unterschiedlichen Ursachen und damit letztlich die Stärken der elektrostatischen Wechselwirkungen. London-Kräfte sind einfach gesprochen (für eine genaue mathematisch-wissenschaftliche Abgrenzung sei auf die einschlägige Fachliteratur verwiesen) Dispersionskräfte, die durch temporäre Ladungsverschiebungen in einem polarisierbaren Teilchen zustande kommen und über Induktion auf Nachbarteilchen wirken. Debey-Wechselwirkungen sind dagegen Induktionswechselwirkungen zwischen einem permanenten Dipol und einem polarisierbaren Nachbarteilchen, wohingegen man die elektrostatischen Wechselwirkungen zwischen zwei Dipolteilchen als Keesom-Wechselwirkung bezeichnet. Wasserstoffbrücken sind 3-Zentren-4-Elektronennebenvalenzbindungen.
Was hilft das nun im schulischen Kontext? Das Vokabellernen von Forschernamen zur Benennung scheint wenig zielführend, auch die sehr detaillierte Unterscheidung über die Form der Wechselwirkung ist für die Schule zu komplex. Was allerdings sinnvoll erscheint, ist die darauf didaktisch reduziert zurückgreifende reine Klassifikation über die Ursache der Wechselwirkung, wie sie bereits im Bildungsplan für Baden-Württemberg vollzogen wird. Man unterteilt die van-der-Waals-Wechselwirkungen lediglich in Wechselwirkungen zwischen temporären (induzierten) Dipolen und Wechselwirkungen zwischen permanenten Dipolen. Die Lernenden müssen keine zusätzlichen Begrifflichkeiten lernen, sondern benennen rein nach den Ursachen, die zu identifizieren sie sowieso erlernen müssen. Die Schwäche der herkömmlichen schulischen Bezeichnung, inkonsequent einen Fall über die zu unspezifizierte Ursache zu benennen, den anderen dagegen mit einem abstrakten Namen, wird somit konsequent umgangen. Der Fall einer Wechselwirkung zwischen temporärem und permanentem Dipol muss nicht extra klassifiziert werden, da er sich jedem Lernenden automatisch erschließt und von ihm auch in seiner Stärke eingeordnet werden kann. Letztlich könnte eventuell sogar der überbegriff der van-der-Waals-Wechselwirkung noch eingespart werden. Daneben stehen als Sonderfall weiterhin die Wasserstoffbrücken. Von der Bezeichnung als Wasserstoffbrückenbindung sollte allerdings Abstand genommen werden, da sie der oben vorgeschlagenen klaren Abgrenzung von Wechselwirkung und Bindung widerspricht. Der Sonderfall am übergang zwischen Wechselwirkung und Bindung kann dadurch betont werden, dass eben auch gerade nicht von einer Wasserstoffbrückenwechselwirkung, sondern lediglich einer Wasserstoffbrücke gesprochen wird.
Die Solvatation, die natürlich einem anderen Sinnzusammenhang entspringt und deshalb auch von der IUPAC klar von den oben angeführten Wechselwirkungen abgegrenzt wird, kann von Lernenden auf Grund dieses theoretischen Fundaments im Themenfeld »Wechselwirkungen zwischen Teilchen« leicht verstanden und als Wechselwirkung zwischen einem Ion (als Monopol) und einem Dipol eingeordnet werden.
Zu D) Bezeichnet man im schulischen Kontext die Wasserstoffbrücken(bindungen) im geschriebenen und gesprochenen Wort konsequent nur als H-Brücken, kann diesen Fehlvorstellungen entgegengewirkt werden. Im Wort − wie in der chemischen Formel − wird die Funktion des gebundenen Wasserstoffatoms als wechselwirkendes Brückenteilchen deutlich.
4 Abwägung
Der Vorschlag versucht durch eine klare, für Lernende nach- vollziehbare und damit begreifbare begriffliche Abgrenzung Verwirrungspotential zu vermeiden. Dies erreicht er zudem sogar durch eine Reduzierung der zu erlernenden Fachbegriffe bei höherer Orientierung an fachwissenschaftlich korrekter Darstellung.
Aus wissenschaftshistorischer Sicht wäre es überlegenswert, ob der Name van-der-Waals aus dem schulischen Kontext komplett verschwinden sollte. Eine Variante wäre beispielsweise von permanenten und temporären Van-der-Waals-Wechselwirkungen statt von Wechselwirkungen zwischen permanenten oder temporären Dipolen zu sprechen. Dabei müsste man sich aber die Frage stellen, ob denn tatsächlich die Wechselwirkungen temporär bzw. permanent sind.
5 Impulse zum Weiterdenken
- Was ist eigentlich polar: die Bindung, der Stoff, das Teilchen oder alles?
- Bilden sich beim Lösen von Kohlenstoffdioxid oder Ether in Wasser H-Brücken?
Nehmen Sie Stellung zu diesem Vorschlag, berichten Sie von Reaktionen Ihrer Schüler, beteiligen Sie sich am didaktischen Prüfstand: Schreiben Sie uns Ihre Kommentare und Anregungen.
Literatur
IUPAC Compendium of Chemical Terminology (the »Gold Book«), doi:10.1351/goldbook.V06597 (18.11.2016)
Pure and Applied Chemistry, 1994, 66, 1077
Römpp-online, https://römpp.thieme.de/roempp4.0/do/data/RD-26-00744 (18.11.2016)
Bildungsplan Baden-Württemberg, http://www.bildungsplaene-bw.de/,Lde/Startseite/ BP2016BW_ALLG/BP2016BW_ALLG_GYM_CH_IK_8-9-10_01_03 (18.11.2016)
Zusammengestellt auf Grundlage der Ergebnisse einer Arbeitsgruppe »Didaktischer Prüfstand« bei der MNU-Chemie-Bundesfachleitertagung 2016 von Carsten Tittel und Matthias Kremer
